Metabolism (IF=11.9)|中国药科大学团队:线粒体“泄漏”为脑缺血帮凶,揭示神经酰胺介导的mtDNA炎症机制!
英文标题:Ceramides increase mitochondrial permeabilization to trigger mtDNA-dependent inflammation in astrocytes during brain ischemia
中文标题:脑缺血期间神经酰胺通过增加线粒体通透性触发星形胶质细胞中依赖线粒体DNA的炎症反应
发表期刊:Metabolism
影响因子:11.9
研究背景
脑卒中(脑缺血)是全球致死致残的首要病因,现有疗法因时间窗狭窄及再灌注损伤限制,难以有效阻止神经功能恶化。近年研究表明,神经炎症是加剧脑损伤的核心机制,而星形胶质细胞作为中枢神经的主要免疫调控者,其炎症激活的“双面性”(保护与损伤)尚未明确。该研究揭示在脑缺血期间,神经酰胺通过增加线粒体通透性,触发星形胶质细胞mtDNA依赖性炎症。
技术路线
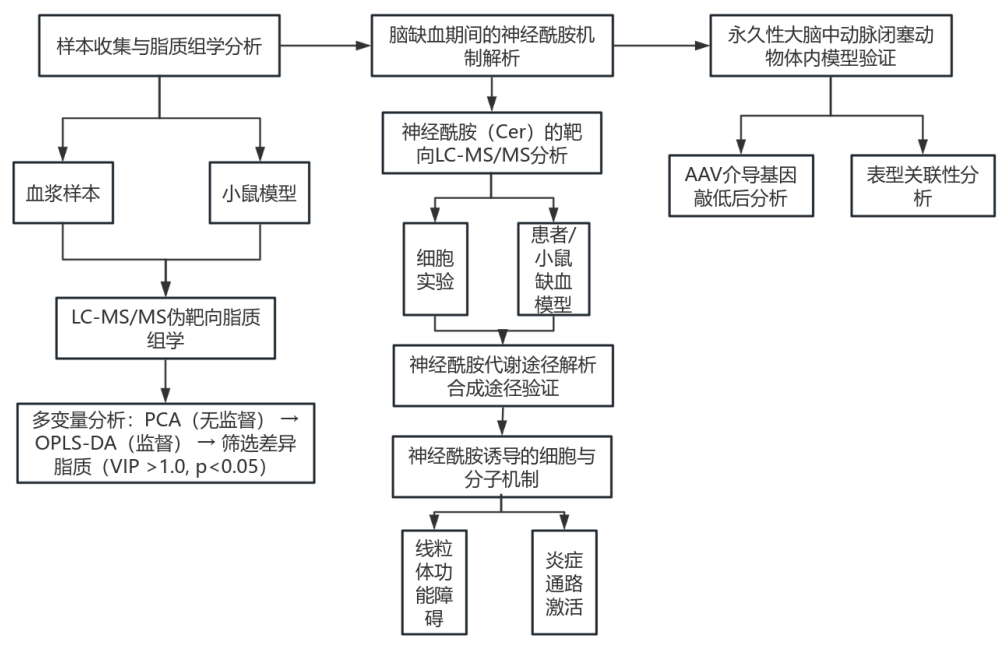
研究结果
1、脑缺血患者血浆中神经酰胺增加
脂质代谢的扰动被认为与缺血性卒中患者的风险和疾病严重程度相关,该研究通过液相色谱-串联质谱(LC-MS/MS)对234例血浆样本(分为健康组(H组)与缺血性卒中组(IS组))进行伪靶标脂质组学分析,检测到485种脂质(图1A)。主成分分析(PCA)显示两组总体脂质谱分离有限(图1B),但正交偏最小二乘判别分析(OPLS-DA)筛选出193种差异脂质(图1C),其中缺血性卒中患者的长链神经酰胺(Cer)及二氢神经酰胺(合成中间体)水平显著升高(图1D)。综上可知,神经酰胺的累积可能通过促进细胞凋亡、炎症或线粒体功能障碍加剧脑损伤。
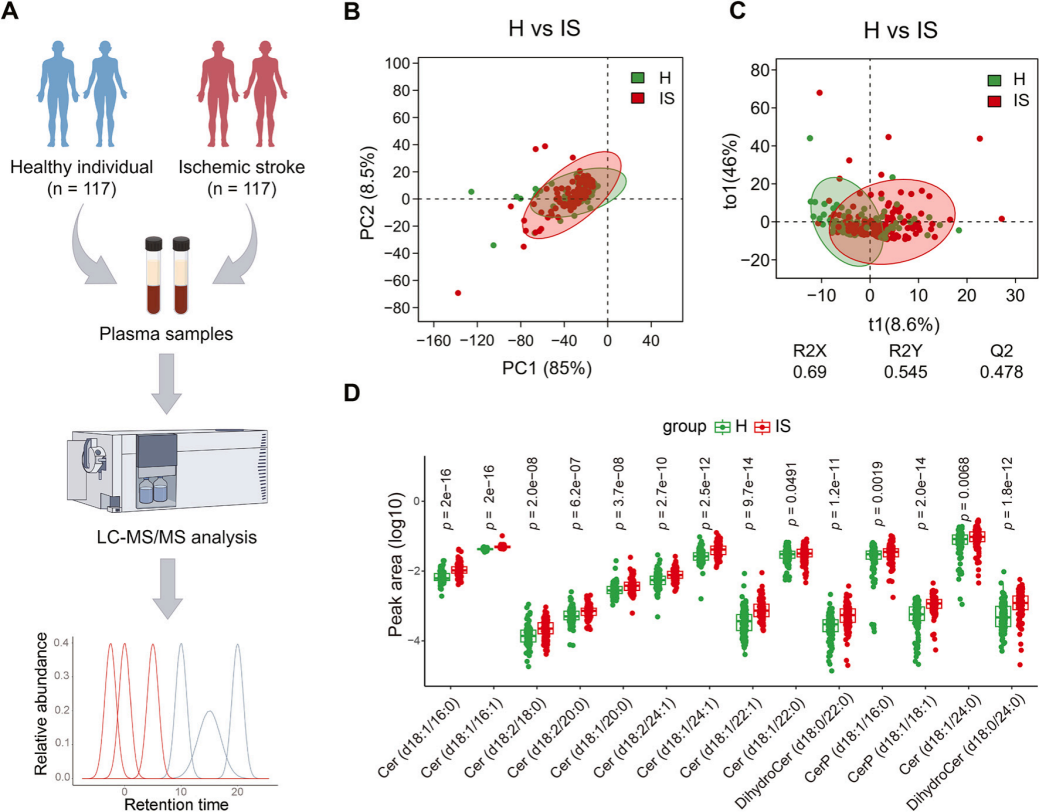
图1. 脂质组学分析健康组和缺血性卒中组的血浆样本
2、缺血小鼠大脑和氧-葡萄糖剥夺刺激的星形胶质细胞中神经酰胺增加
为了进一步证实脑缺血条件下长链神经酰胺的上调,该研究进行永久性大脑中动脉闭塞(pMCAO)小鼠模型及离体氧糖剥夺(OGD)脑切片实验。研究发现,与假手术组相比,pMCAO小鼠的血清和脑组织中总神经酰胺水平显著升高(图2A-B),且OGD处理的离体脑切片也呈现类似趋势(图2C)。LC-MS/MS分析证实,pMCAO小鼠血清和脑组织中单个长链神经酰胺(图2D-E)及二氢神经酰胺(合成中间体,图2F-G)均显著增加。进一步细胞实验表明,OGD刺激可特异性诱导原代星形胶质细胞(图2H)和人胶质母细胞瘤细胞系U251(图2I)的神经酰胺合成,但对原代神经元无显著影响(图2J)。因此,神经酰胺的缺血依赖性生成可能与神经胶质细胞活化相关。
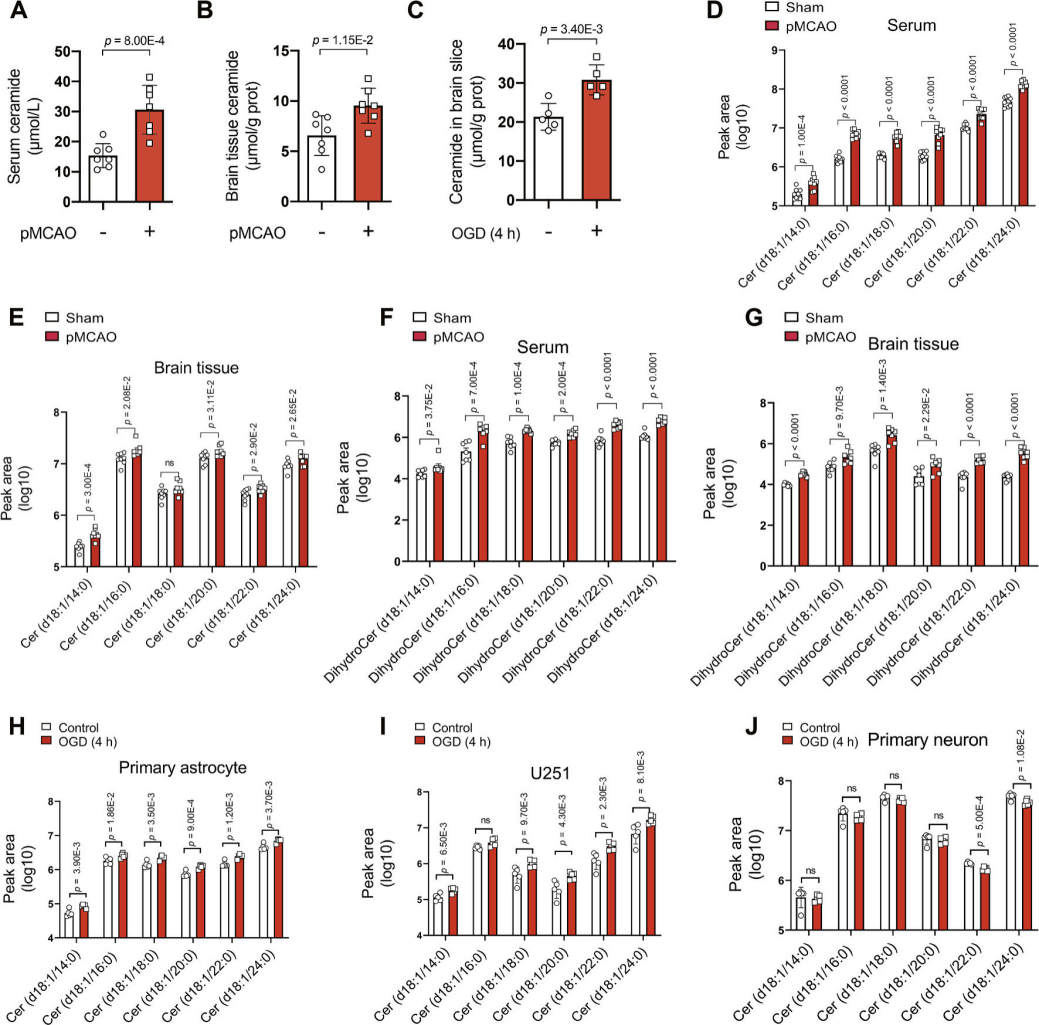
图2. pMCAO小鼠的血清和脑组织中以及OGD刺激的脑切片和细胞中的神经酰胺含量分析
3、神经酰胺主要由从头合成途径产生
神经酰胺来源于三个主要代谢途径:鞘氨醇补救途径,鞘磷脂循环途径,以及丝氨酸棕榈酰转移酶(SPT)介导的从头合成途径(图3A)。在pMCAO小鼠脑组织及OGD处理的星形胶质细胞中,丝氨酸棕榈酰转移酶(SPT)相关基因(Sptlc1、Sptlc2)表达显著上调(图3B-C),而鞘磷脂循环途径关键酶基因(Smpd2、Smpd3)表达下降。因此,神经酰胺的合成从鞘磷脂水解向从头合成途径偏移。进一步实验显示,SPT抑制剂肉豆蔻素可显著抑制OGD诱导的神经酰胺生成(图3E),而星形胶质细胞中敲低Sptlc2基因亦能减少神经酰胺累积(图3F),直接验证了该途径的核心作用。此外,OGD刺激虽上调神经酰胺降解酶基因(Acer2、Acer3,图3G),但其代偿性调节不足以抵消从头合成的神经酰胺激增。综上可知,缺血通过激活星形胶质细胞的SPT介导的从头合成途径驱动神经酰胺异常累积,而神经元未参与此过程(图3D)。
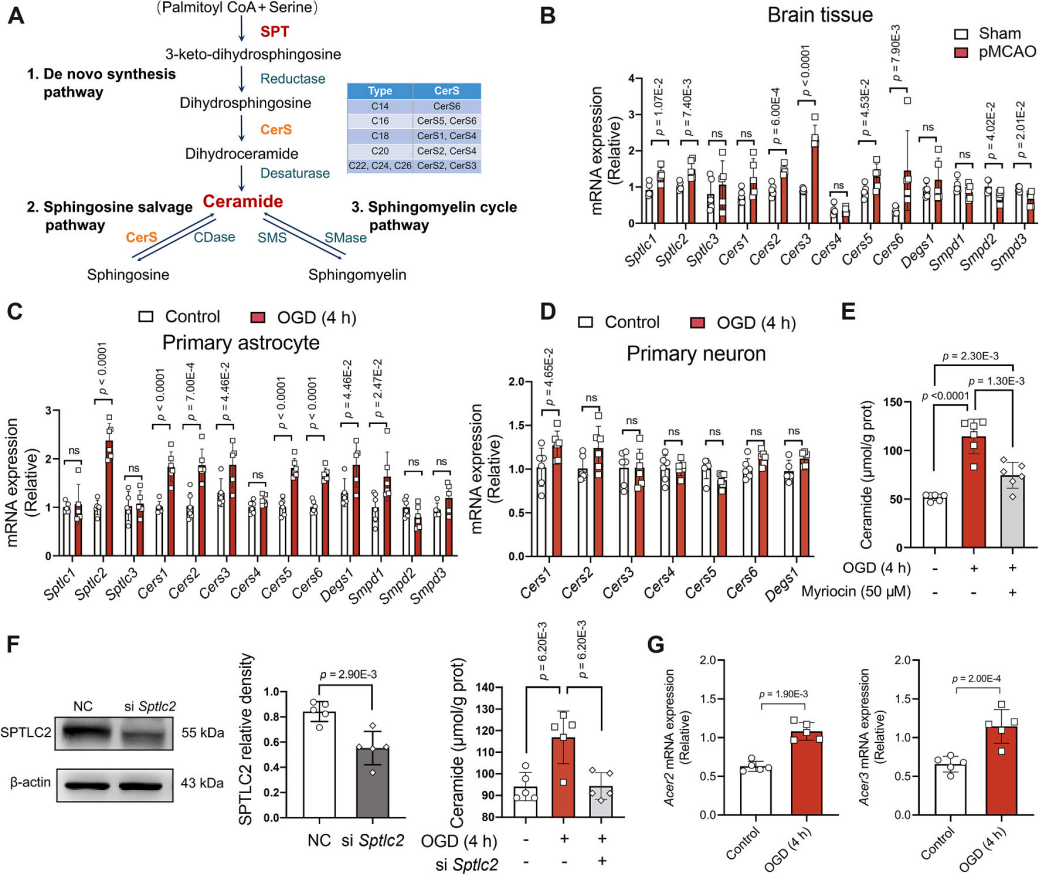
图3. 星形胶质细胞中的神经酰胺合成基因表达
4、神经酰胺诱导的星形胶质细胞再激活
该研究利用C2-神经酰胺(水溶性神经酰胺类似物)处理星形胶质细胞(图4A),发现其可以直接导致星形胶质细胞再激活。星形胶质细胞中GFAP荧光和Edu染色分析,发现C2-神经酰胺可模拟内源性神经酰胺功能,促使星形胶质细胞再激活,表现为GFAP表达上调(图4B)、活性氧(ROS)及钙离子浓度呈剂量依赖性升高(图4C-D),并促进细胞增殖(图4E)。这种激活效应独立于神经酰胺的从头合成途径及鞘氨醇1-磷酸代谢。研究发现,在氧糖剥夺(OGD)条件下,星形胶质细胞糖酵解能力显著受损,而敲低SPT关键基因Sptlc2可逆转这种代谢抑制(图4G),这就表明神经酰胺通过破坏星形胶质细胞的代谢稳态加剧其功能障碍。综上可知,C2-神经酰胺通过直接触发星形胶质细胞活化及代谢紊乱,参与缺血病理进程。
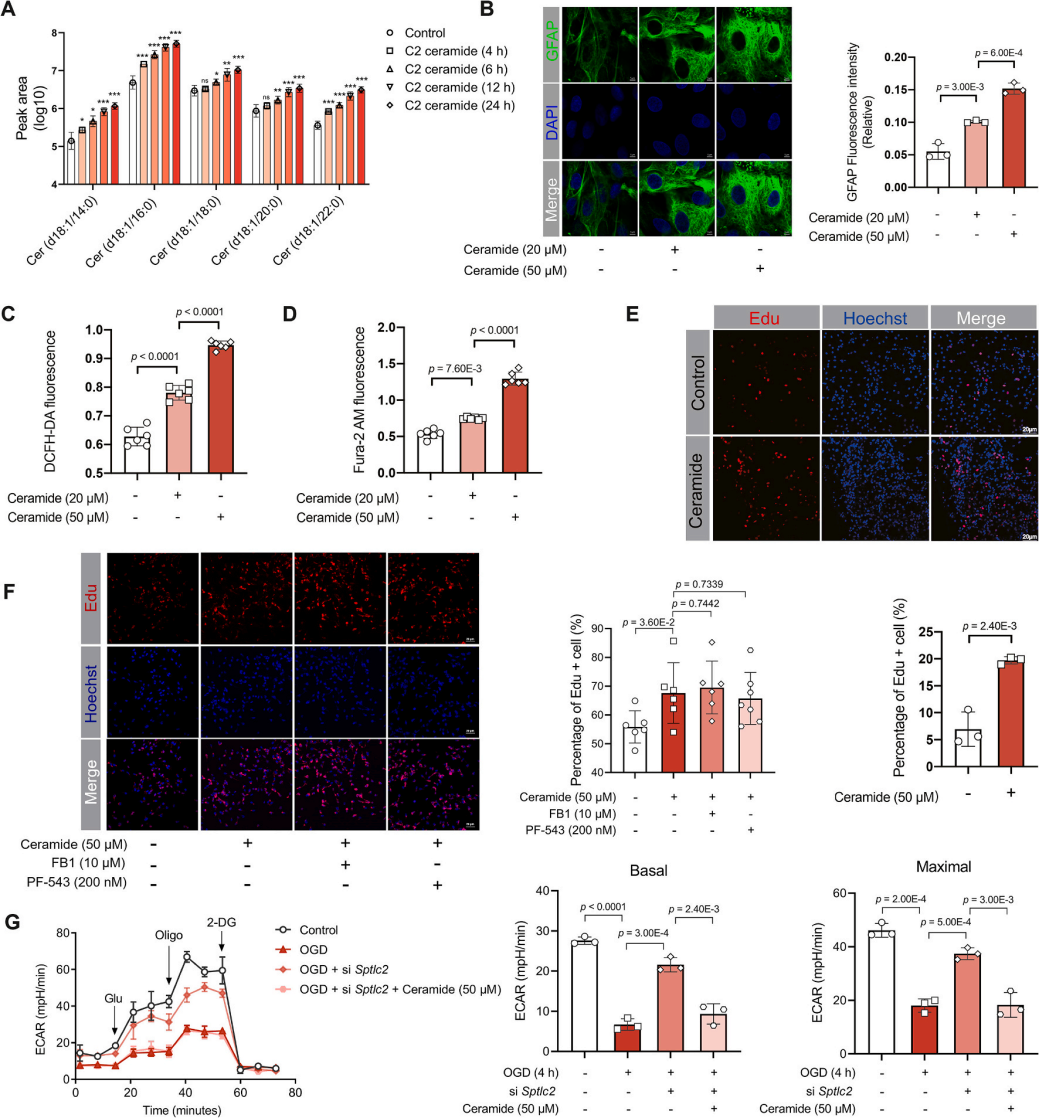
图4. 神经酰胺诱导星形胶质细胞再活化
5、神经酰胺以损害线粒体完整性来促进mtDNA释放
ROS产生和钙负荷分析显示,敲除Sptlc2基因可减少氧糖剥夺损伤下星形胶质细胞的活性氧生成和钙过载(图5A-B),而外源性神经酰胺的添加可逆转这一抑制效应,这就表明神经酰胺通过线粒体功能障碍发挥作用。研究还发现,神经酰胺促进线粒体通透性转换孔(mPTP)开放及膜电位崩溃(图5C-D),并降低线粒体氧化磷酸化能力(耗氧率OCR,图5E),但这些异常均被线粒体ROS清除剂SKQ1逆转,表明氧化应激是核心驱动因素。此外,神经酰胺诱导电压依赖性阴离子通道VDAC1寡聚化(图5F),促进线粒体DNA(mtDNA)外泄(图5H),而OGD诱导的VDAC1寡聚化依赖于神经酰胺合成,因Sptlc2缺陷可阻断此过程(图5G)。综上可知,神经酰胺通过氧化应激破坏线粒体膜完整性,引发类似糖尿病心脏病变的线粒体质量控制失调,最终导致mtDNA逃逸,加剧缺血性损伤。
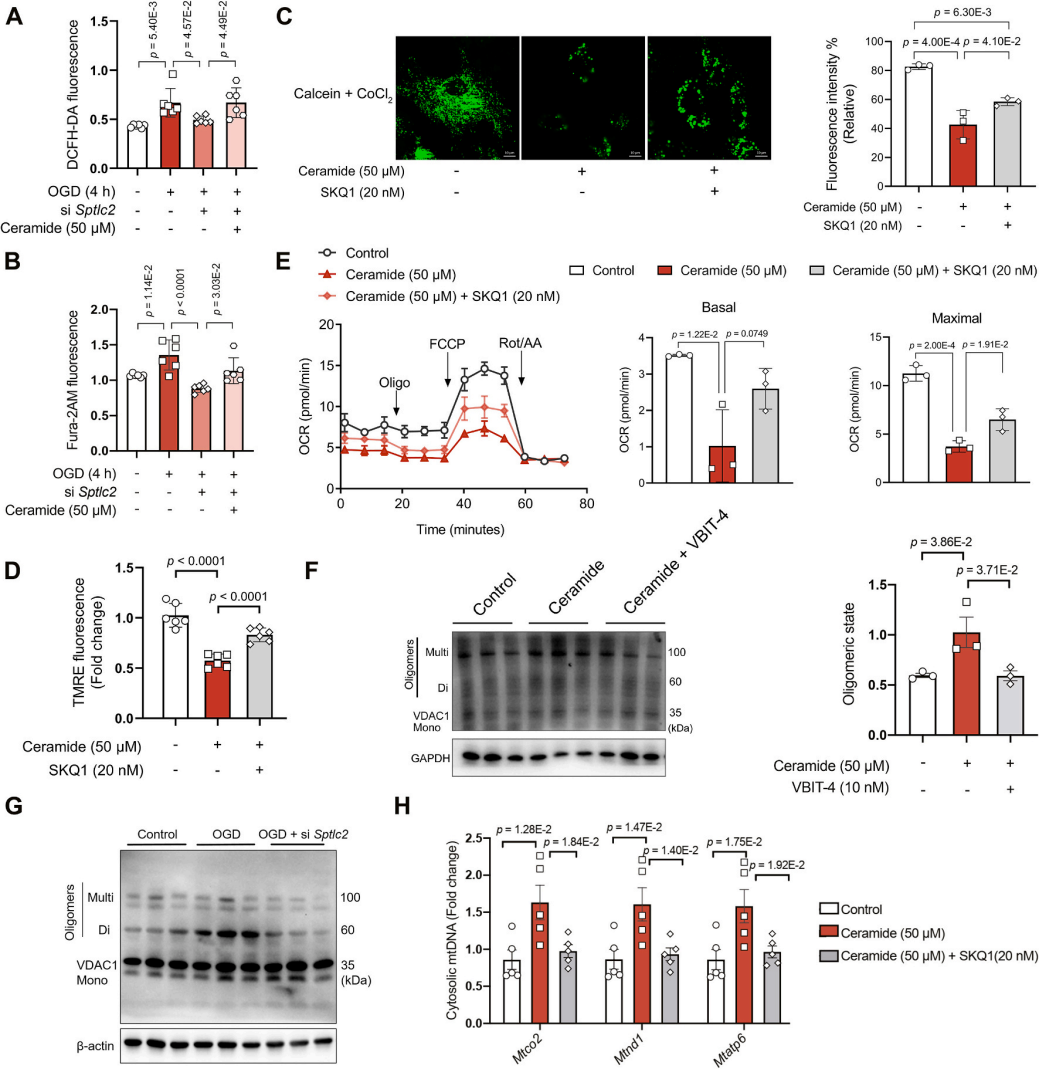
图5. 神经酰胺诱导线粒体功能障碍
6、神经酰胺触发星形胶质细胞中cGAS/STING通路干扰素反应
该研究揭示神经酰胺通过干扰mtDNA代谢驱动缺血性星形胶质细胞炎症反应的机制。在氧糖剥夺刺激下,星形胶质细胞中DNase II蛋白表达下降(图6A),且神经酰胺通过降低DNase II热稳定性进一步减少其丰度,导致mtDNA积累(图6B-C);释放至胞质的mtDNA激活cGAS-STING通路,促进cGAMP生成并招募TBK1,进而磷酸化IRF3和NF-κB(图6D-F),触发其核转位(图6G)及促炎基因(Il-1β、Il-6、Tnfα)和干扰素基因(Ifnα、Ifnβ、Cxcl10)的转录上调(图6H-I)。但是,敲低Sptlc2基因可阻断上述炎症级联反应,外源性神经酰胺的添加也可逆转这一抑制效应。因此,神经酰胺的从头合成是炎症激活的核心驱动因素(图6D-I)。缺血通过神经酰胺依赖的DNase II抑制及cGAS-STING通路激活,将线粒体损伤与神经炎症直接关联,加剧脑缺血病理进程。
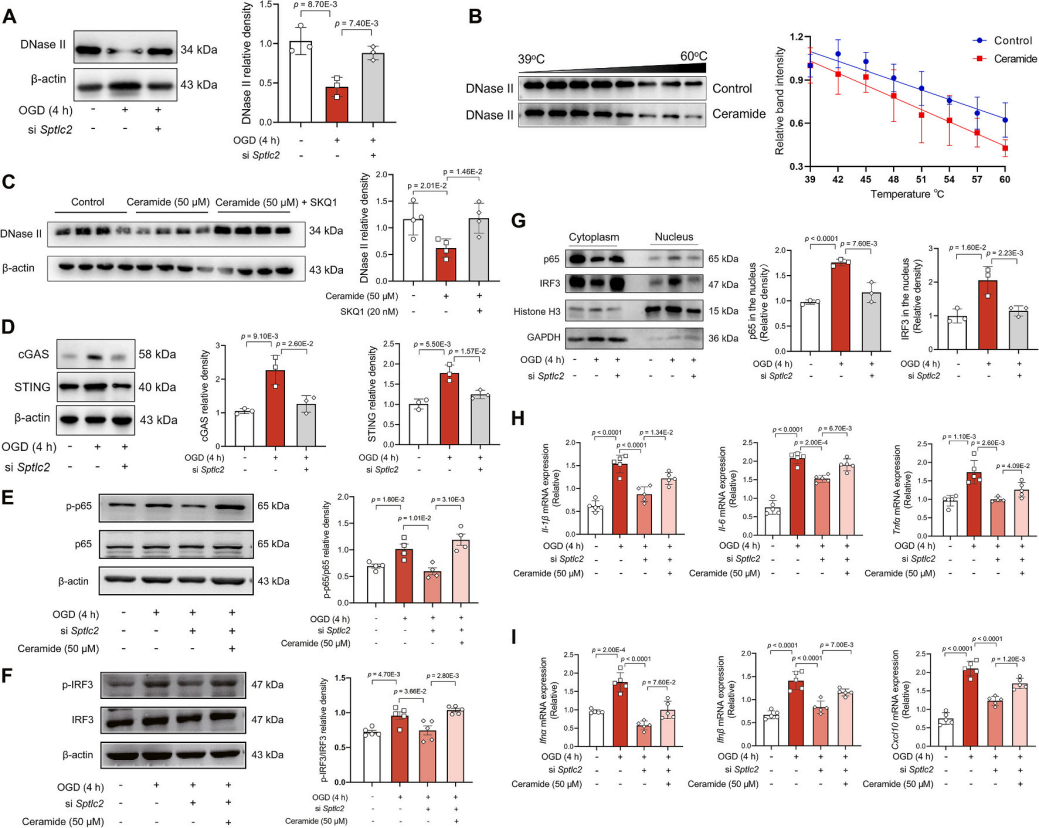
图6. 神经酰胺诱导星形胶质细胞的干扰素反应
7、SPTLC2缺陷抑制脑cGAS/STING通路相关干扰素反应
为了确认神经酰胺对体内脑缺血损伤的影响,该研究通过向小鼠侧脑室注射AAV9-Sptlc2 shRNA病毒(图7A),成功敲低脑内Sptlc2基因表达,验证神经酰胺在体内脑缺血损伤中的关键作用。结果显示,Sptlc2敲低显著减少缺血半影区神经酰胺生成(图7C),并减轻脑损伤(图7D),表现为星形胶质细胞失活(图7E)、ROS水平下降(图7F)及胞质mtDNA积累减少(图7G)。同时,该干预抑制了cGAS活性(图7H)、STING蛋白表达及IRF3磷酸化(图7I),进而削弱促炎因子和干扰素相关基因的转录(图7J-K)。这些体内数据与体外星形胶质细胞实验结果一致,共同证实神经酰胺通过驱动线粒体损伤-mtDNA泄漏-cGAS/STING通路轴,触发缺血后神经炎症,而以Sptlc2介导的神经酰胺合成为靶点可有效缓解这一病理进程。
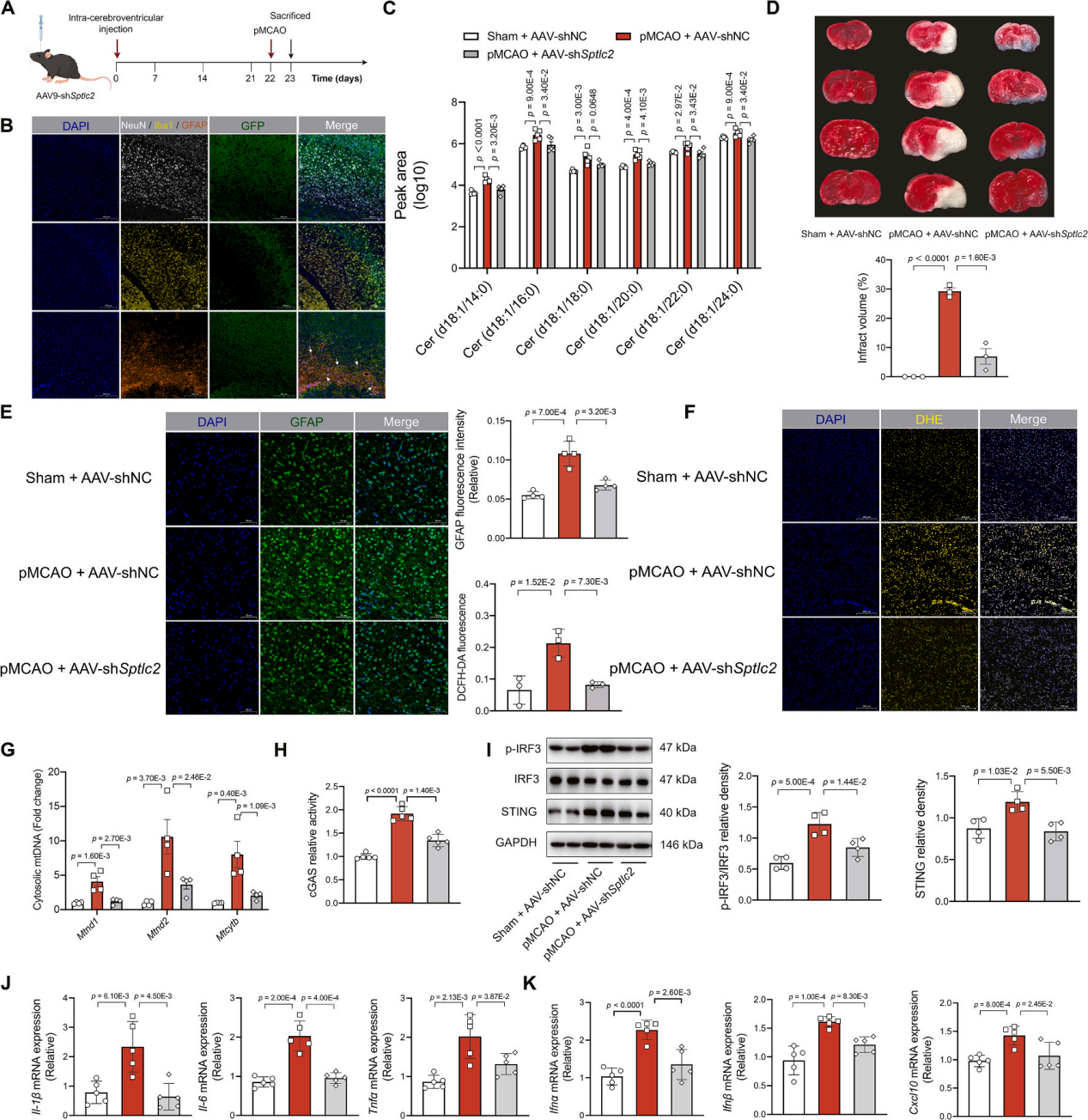
图7. SPTLC2缺陷阻断cGAS/STING信号级联反应
研究结论
研究证实,在缺血性脑损伤中,星形胶质细胞通过SPTLC2介导的神经酰胺从头合成,触发线粒体功能障碍及mtDNA泄漏,进而激活cGAS-STING通路依赖性炎症反应,最终加剧神经炎症损伤,而抑制Sptlc2可显著减轻上述病理过程。该研究发现提出了一种新的药物干预治疗策略,为减轻神经炎症以及未来开发特异性干预策略提供了新思路。
END
hao 撰文
Winly 校稿

