
编者按
肌肉萎缩发生在自然衰老和疾病状态下,肌肉细胞凋亡被认为是肌肉萎缩的主要原因之一,但最近的研究表明,肌肉细胞在肌肉萎缩过程中不会凋亡。
今天,我们分享2025年2月4日由澳门大学健康科学学院罗茜教授团队在Advanced Science上发表的题为“FRET-Based Sensor Zebrafish Reveal Muscle Cells Do Not Undergo Apoptosis in Starvation or Natural Aging-Induced Muscle Atrophy”的最新研究成果。该研究通过构建由饥饿和自然衰老诱导的斑马鱼肌肉萎缩模型,表明尽管在饥饿或衰老诱导的肌肉萎缩期间肌肉质量会大大减少,但肌肉细胞不会因凋亡而死亡,而是通过自噬保持存活,为肌肉萎缩机制探究提供了新的见解,有利于推动肌肉萎缩相关疾病的治疗。
研究结果显示,两种模型中肌肉细胞直径均显著减小,但未观察到肌肉细胞凋亡。在饥饿模型中,肌肉细胞核数量保持恒定,肌肉组织中巨噬细胞数量未增加,进一步证实肌肉细胞未死亡。转录组分析表明,凋亡通路下调,而自噬和蛋白质降解通路上调。
文章题目
FRET-Based Sensor Zebrafish Reveal Muscle Cells Do Not Undergo Apoptosis in Starvation or Natural Aging-Induced Muscle Atrophy
杂志:Advanced Science(IF=14.3)
发表时间:2025年2月4日
作者:贾皓、吴仁飞、杨红梅、罗茜教授等
单位:澳门大学健康科学学院等
01、研究亮点
• 将一种基因编码的蛋白荧光探针特异性地表达在斑马鱼的肌肉组织中,并构建了饥饿与自然衰老诱导的斑马鱼肌肉萎缩模型开展双模型验证,实现了肌肉细胞凋亡的实时动态观察;
• 首次揭示了肌肉细胞在饥饿和自然衰老引起的肌肉萎缩中并不会死亡,而是通过自噬保持存活,重新定义肌肉萎缩的分子机制;
• 发现自噬(LC3-II表达上调)、线粒体自噬(mitophagy)和泛素-蛋白酶体系统(ubiquitin-proteasome)是肌肉萎缩的核心通路,强调了自噬和蛋白质降解的核心地位,为开发营养干预或靶向自噬的药物提供了依据。
02、研究背景
肌肉萎缩是指肌肉质量和肌肉力量的丧失,其主要诱因包括衰老、缺乏运动、饥饿、神经损伤及某些疾病,如肿瘤和库欣病等。肌肉萎缩发生机制主要包括:蛋白质合成减少、降解增加;肌肉干细胞耗竭;肌肉细胞死亡等。
与前两种机制不同,肌肉细胞死亡,尤其是凋亡,在肌肉萎缩中的作用颇具争议。已有多项研究证实肌肉萎缩过程中会发生肌肉细胞凋亡。在衰老动物的肌肉组织中,观察到氧化损伤、线粒体功能障碍、caspase激活及其他凋亡标志物升高等。通过脱氧核苷酸末端转移酶介导的dUTP缺口末端标记(TUNEL)技术发现,成年兔骨骼肌在缺乏运动2-6天后,肌肉细胞凋亡增加。
更多的研究表明,在废用性肌肉萎缩中,骨骼肌活性氧水平、caspase-3活性及TUNEL信号显著升高。活体成像及TUNEL法检测显示,肌肉细胞线粒体损伤和细胞凋亡导致小鼠神经源性肌肉萎缩。肿瘤细胞来源的外泌体等可以通过激活caspase-3和细胞凋亡来诱导肌肉萎缩。在饥饿诱导的肌肉萎缩中,肌肉组织内检测到活化的caspase-3。
然而,最近的多项研究认为,小鼠神经源性肌肉萎缩或昆虫节间肌诱导的肌肉萎缩中,均未发生肌肉细胞凋亡。这可能有一部分原因是由于肌肉细胞的多核特性及庞大的体积造成的,这使得与其他组织中的单核细胞相比,鉴定和表征肌肉细胞的凋亡更加困难。
本研究旨在利用斑马鱼活体成像技术,探究肌肉细胞凋亡是否是斑马鱼肌肉萎缩的主要原因。为了检测肌肉细胞凋亡,研究人员构建了转基因斑马鱼Tg(mylz2:sensor C3),将一种基因编码的蛋白荧光探针特异性地表达在斑马鱼的肌肉组织中。前期研究已表明,该探针在癌细胞和斑马鱼细胞存活时呈绿色荧光,而在caspase-3激活的凋亡细胞中则变为蓝色荧光。
研究发现,Tg(mylz2:sensor C3)斑马鱼可通过单细胞分辨率的颜色变化来检测肌肉细胞凋亡,并且可用于长期追踪斑马鱼单个肌肉细胞的凋亡情况。通过构建饥饿和自然衰老诱导的斑马鱼肌肉萎缩模型,研究人员发现,尽管肌肉质量显著减少,但肌肉细胞并未通过细胞凋亡而死亡。
03、研究结果
1. 可视化追踪斑马鱼肌肉细胞凋亡
为了长期追踪斑马鱼肌肉细胞凋亡,研究人员将一种基因编码的蛋白荧光探针特异性地表达在斑马鱼的肌肉组织中。该探针在癌细胞和斑马鱼细胞存活时呈绿色荧光,而在caspase-3激活的凋亡细胞中则变为蓝色荧光。
凋亡诱导药物Raptinal处理斑马鱼后,观察到明显的TUNEL阳性信号和蓝色肌肉细胞。自然发育过程中少量的凋亡肌肉细胞亦可以被荧光探针检测到,该探针斑马鱼还可以用来跟踪巨噬细胞对凋亡细胞的吞噬清除。
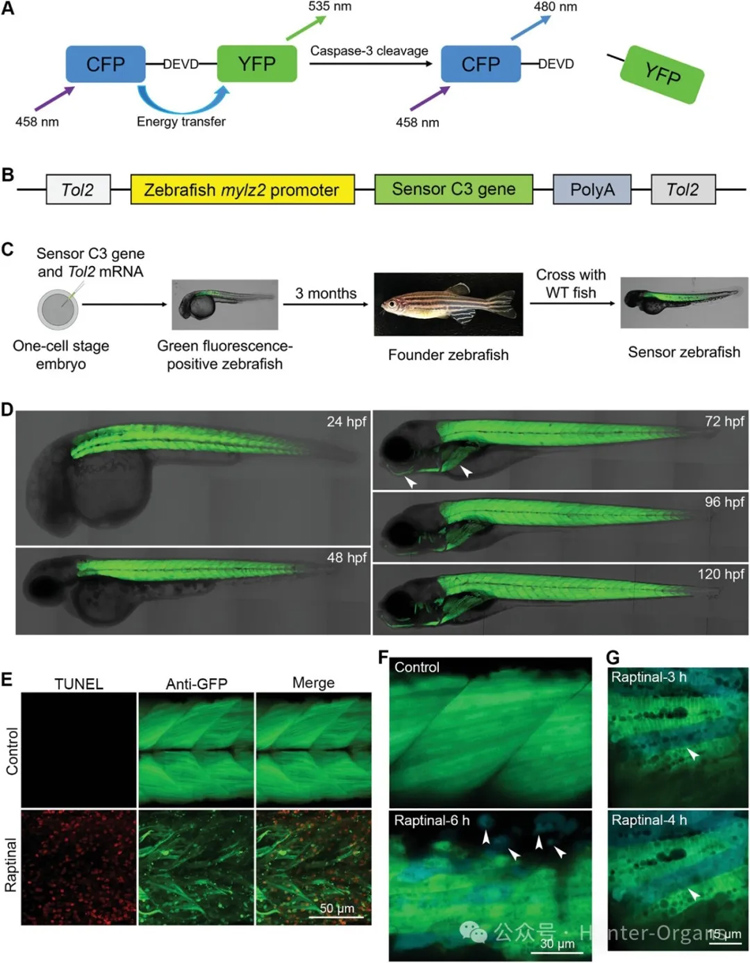
图1
研究发现,在压力条件下及正常发育过程中,Tg(mylz2:sensor C3)斑马鱼可用于可视化追踪肌肉细胞凋亡情况。在先前研究中,研究人员观察到在5-10分钟内,蓝色凋亡皮肤、间质或神经元细胞可以快速分解成凋亡体;在caspase-3激活后,凋亡肌肉细胞的形态可以维持至少1小时乃至更长时间。通过为期两周的跟踪监测发现,发育过程中的斑马鱼,只有极少数肌肉细胞通过凋亡而死亡。
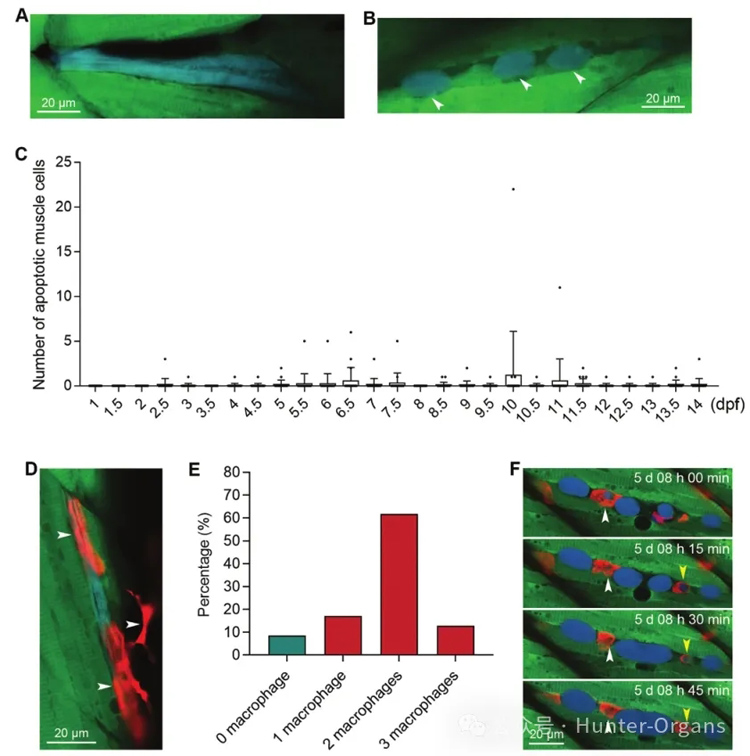
图2
2. 构建饥饿诱导的斑马鱼肌肉萎缩模型
研究人员构建了饥饿诱导的斑马鱼肌肉萎缩模型,将受精后5天(dpf)的斑马鱼分两组实验,结果表明,在5dpf时,饥饿组斑马鱼的游泳速度比对照组低78%。为证实5天的饥饿会诱发肌肉萎缩,研究人员对斑马鱼肌肉组织进行了三维成像,并测量肌肉组织横截面积。结果表明,饥饿诱导后,斑马鱼肌肉组织明显减小。饥饿组的面积比对照组低25%,比5dpf时低30%;饥饿组的肌细胞直径比对照组低40%,比5dpf时低37%。
进一步测量在饥饿治疗前后2种常见肌肉萎缩标志物——MuRF1和Atrogin-1的mRNA水平发现,饥饿组MuRF1的mRNA水平比对照组高14倍,比5dpf组高12.7倍;饥饿组Atrogin-1的mRNA水平比对照组增加195.6倍,比5dpf组增加9.7倍。这些数据表明,饥饿会诱发肌肉萎缩。
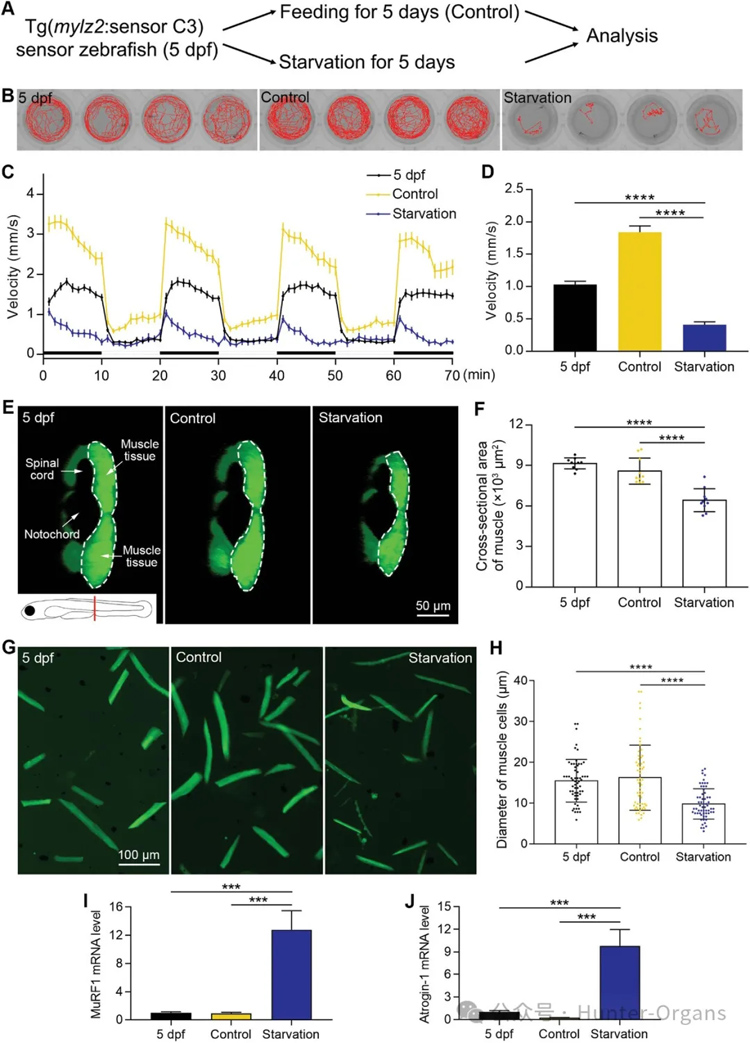
图3
3. 细胞凋亡与饥饿诱导的肌肉萎缩无关
为进一步确定饥饿诱导的肌肉萎缩过程中是否会发生肌肉细胞凋亡,研究人员通过荧光跟踪拍摄发现,在肌肉萎缩过程中,并未检测到蓝色凋亡细胞,也未观察到肌肉组织中巨噬细胞的富集。
实验数据表明,肌肉萎缩后肌肉细胞的细胞核数量保持不变(图4E),这表明在饥饿诱导的肌肉萎缩过程中肌肉细胞没有发生凋亡。此外,凋亡的肌肉细胞可能被巨噬细胞吞噬,定量结果显示,在饥饿处理5天后,巨噬细胞数量没有增加(图4G),这表明在饥饿诱导的肌肉萎缩过程中没有发生明显的肌肉细胞死亡。
这些结果都表明,在饥饿诱导的肌肉萎缩过程中,肌肉质量损失是由于肌肉细胞的减小,而不是肌肉细胞凋亡。
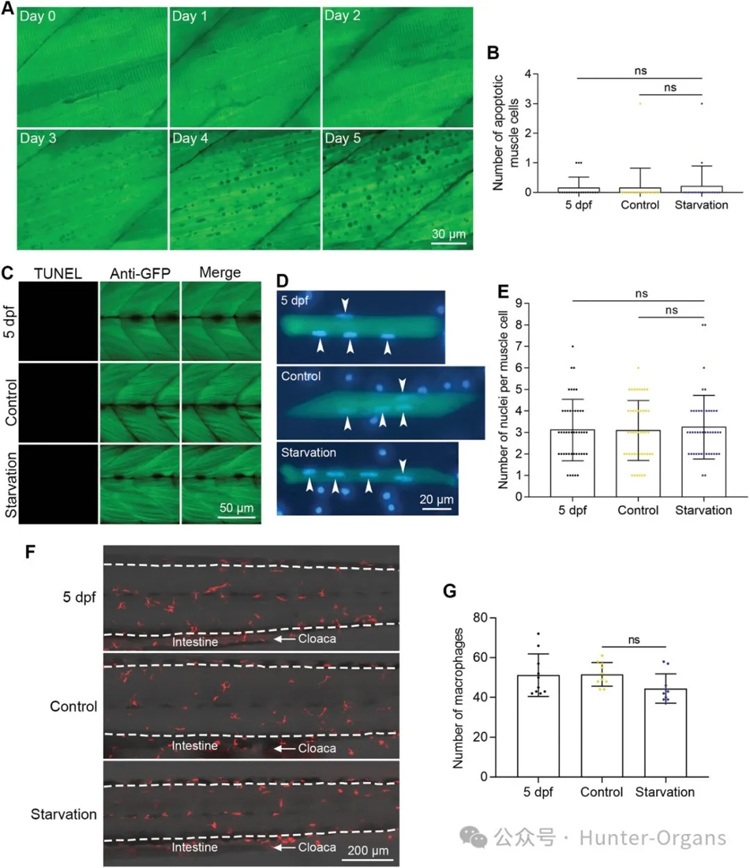
图4
4. 在饥饿诱导的肌肉萎缩中,肌肉细胞发生自噬
尽管没有观察到蓝色的肌肉细胞凋亡,但研究人员注意到在饥饿处理3天后,肌肉细胞中开始出现大量的小囊泡,这些囊泡从4-5天起越来越大(图4A)。
由于囊泡形成是自噬的标志之一,为了验证在饥饿诱导的肌肉萎缩中肌肉细胞发生了自噬,研究人员通过高分辨率的单细胞成像观察到,这些囊泡通常位于肌肉细胞边缘(图5A),可以帮助肌肉细胞在严重压力下也能保持收缩力,且这些囊泡与溶酶体具有共定位,表明是自噬性囊泡。
蛋白印迹检测显示自噬标志物LC-II的水平随着肌肉萎缩的进展逐渐升高;RNA测序分析显示萎缩的肌肉组织中自噬相关通路和基因显著上调,重新对肌肉萎缩的斑马鱼进行喂养后,自噬囊泡还会消失。
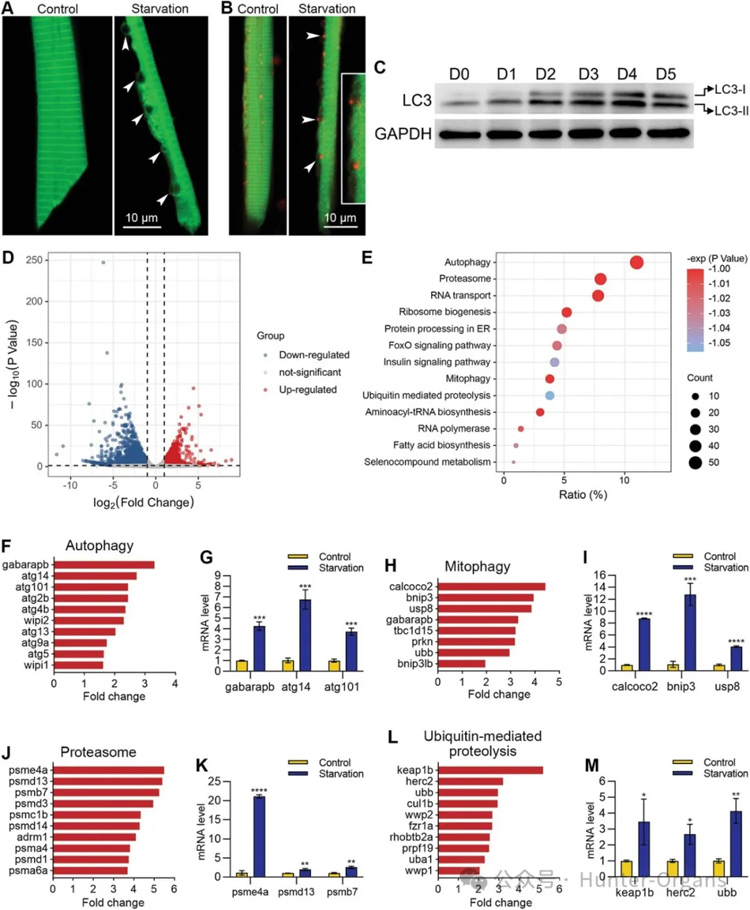
图5
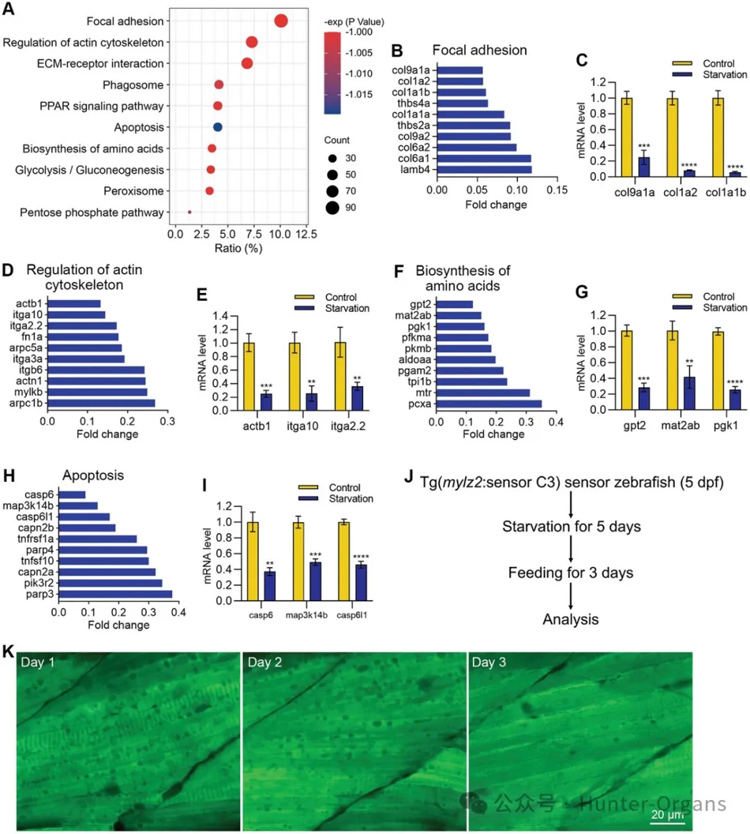
图6
5. 自然衰老诱导的斑马鱼肌肉萎缩中,未观察到肌肉细胞凋亡
此外,研究人员还建立了自然衰老诱导的斑马鱼肌肉萎缩模型。正常条件下饲养斑马鱼五年,长期跟踪发现一些斑马鱼出现了肌肉萎缩。对出现肌肉萎缩表型的斑马鱼进行测量,结果显示,这些肌肉萎缩的斑马鱼肌肉细胞平均直径显著减少了57%,肌肉萎缩的斑马鱼中MuRF1的mRNA水平比年轻斑马鱼增加了39.7倍,其Atrogin-1的mRNA水平增加了15.1倍。
为验证肌肉萎缩的斑马鱼是否发生了肌肉细胞凋亡,研究人员通过荧光检测发现,所有萎缩的肌肉中均没有明显的蓝色凋亡肌肉细胞(图7H)。TUNEL试验也表明,自然衰老诱导的斑马鱼肌肉萎缩中,没有发生细胞凋亡。转录分析显示,具有肌肉萎缩表型的斑马鱼肌肉组织中,自噬相关的基因表达水平上调,而凋亡相关的基因则下调表达。
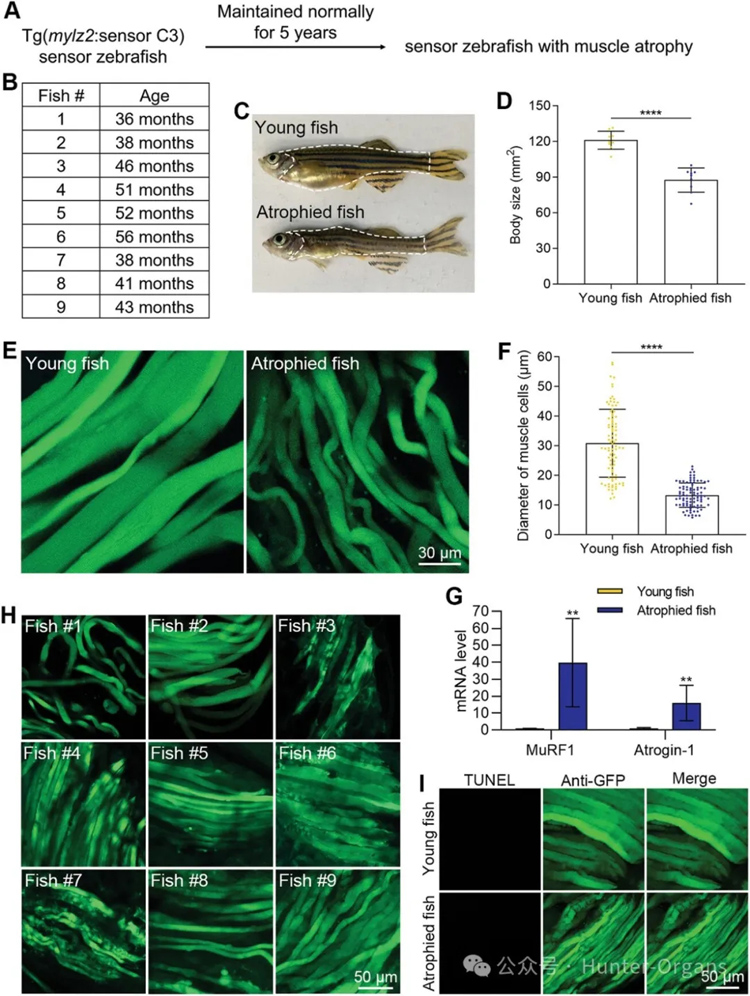
图7
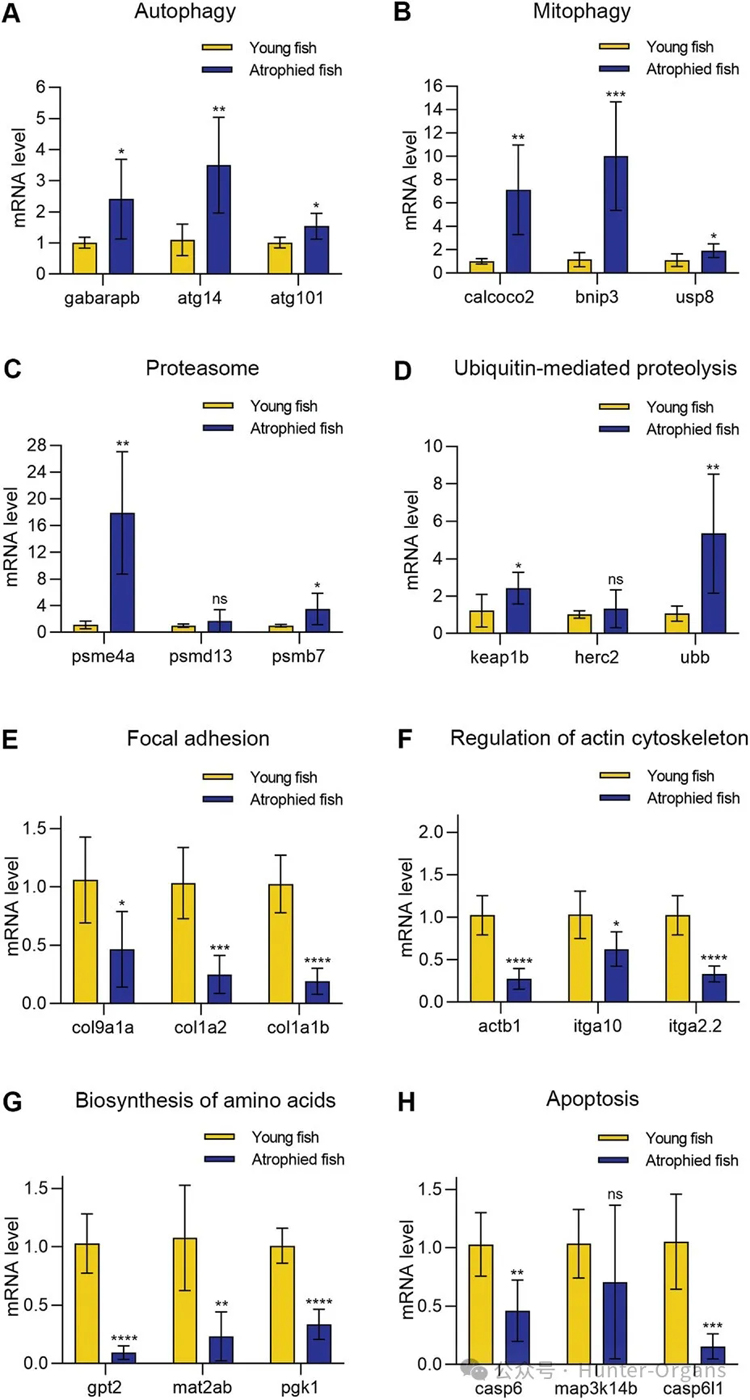
图8
04、编者点评
本研究将一种基因编码的蛋白荧光探针特异性地表达在斑马鱼的肌肉组织中,并构建了饥饿和自然衰老诱导的斑马鱼肌肉萎缩模型,揭示了肌肉细胞在饥饿和自然衰老引起的肌肉萎缩中并不会死亡而是通过自噬保持存活,重新定义肌肉萎缩的分子机制,强调自噬和蛋白质降解的核心地位,为肌肉萎缩治疗提供了新靶点。
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”多维生物技术服务体系,开展健康美丽CRO服务、科研服务、智慧实验室搭建三大业务。目前,环特已建立200多种斑马鱼模型,胃癌、脑类器官、心脏类器官及各种肿瘤类器官培养平台,欢迎有需要的读者垂询!
